1. Átomos y moléculas
Toda la materia,
no importa lo sólida que usted le parezca está hecha de pequeños “bloques de
construcción”, que también están a su vez mayoritariamente constituidos por
espacio vacío.
Esto es lo que llamamos átomos; Son las unidades más pequeñas de una sustancia
elemental que conservan las propiedades químicas de esa sustancia, la cual
llamamos elemento.
Algunos elementos pueden combinar sus átomos para formar moléculas como el agua, y
compuestos y todas las sustancias de las que está hecha
la materia.
|
|
|
- Todo está hecho de átomos.
A la fecha se conocen unos 118 átomos diferentes, los que llamamos elementos químicos (94 naturales y 24 sintéticos).
El hidrógeno
(H) es el elemento más liviano y original formado después del Big-Bang
y constituye el 90% de todo el universo. El resto de los elementos fueron
formados en estrellas.
- Somos polvo de estrellas.
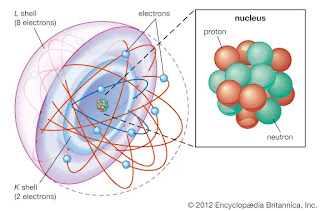
Los átomos consisten de un núcleo masivo en el centro, constituido por dos tipos de partículas los
protones que tienen una unidad de carga eléctrica (positiva) y
los neutrones que no tienen carga eléctrica.
Fuera del núcleo, pero cerca de él, en una región prácticamente vacía, están
los electrones que tiene carga eléctrica elemental negativa.
- El átomo es neutro en cuanto carga eléctrica, pues tiene igual número de electrones que de protones.
- Los átomos no tienen edad. Están en todas partes desde el inicio del tiempo, reciclados de innumerables formas.
En 1987 el botánico Robert Brown observó con un microscopio el movimiento errático de granos de polen y en 1905 Albert Einstein explicó este fenómeno como el resultado de colisiones con moléculas de agua, evidencia de la existencia de átomos.
- Dos o más átomos del mismo o diferente elemento se pueden combinar para formar moléculas.
Así, dos átomos de hidrógeno
y uno de oxígeno, producen una molécula de agua. Pero también dos átomos de
oxígeno forman una molécula de dicho gas, como el que se encuentra en el aire que
respiramos.
Una molécula es
la menor división de la materia que mantiene las propiedades químicas de la
sustancia que la originó.
Las
sustancias de la vida son moléculas, como las proteínas.
Los
seres vivos están formados por células hechas con
moléculas principalmente de cuatro elementos; carbono (C), hidrógeno
(H), oxígeno (O) y nitrógeno (N).
El aire (mezcla de gases) de la atmósfera de la Tierra contiene 78% de nitrógeno, 21% de oxígeno, 0,9% de argón, 0,04% de dióxido de carbono y trazas de hidrógeno, helio y una cantidad variable de vapor de agua.
| Un átomo de sodio que pierde un electrón se transforma en un ión de sodio. |
Sin embargo, muchas sustancias como rocas, sales y metales, están
compuestas de redes cristalinas de
átomos llamadas iones
unidos químicamente, pero no están hechas de moléculas discretas.
- Un ión es un átomo o una molécula que de alguna manera ha ganado o perdido electrones, quedando entonces esta “partícula” con carga eléctrica negativa o positiva, debido al desbalance con la carga de los protones.
Por ejemplo,
cuando la sal común (cloruro de sodio) se disuelve en agua, se forma dos iones,
uno del cloro que es negativo y otro del sodio que es positivo.
2. Sólidos, líquidos, gases
y plasma
La materia existe en cuatro fases (estados): sólido, líquido,
gaseoso y plasma.
En
todos las fases las moléculas siempre están en movimiento.
En
los sólidos las moléculas vibran alrededor de posiciones relativamente
fijas.
En
los líquidos las moléculas poseen mayor energía de vibración y
sus posiciones no son fijas. Los líquidos toman la forma del recipiente que las
contiene.
Si
las moléculas poseen mucha más energía, las vibraciones son más intensas y se
liberan unas de las otras, pasan al estado gaseoso. Los gases
llenan completamente el volumen del recipiente que los contiene.
Se
acostumbra llamar fluidos a
los líquidos y los gases, porque son sustancias se les puede hacer fluir o
moverse con cierta facilidad. En cualquier fluido, las moléculas están en
movimiento constante y aleatorio, chocando entre sí y con las paredes del recipiente.
- ¡Cualquier sustancia puede ocurrir en cualquier fase!
- Los cambios de fase de la materia son cambios físicos, no cambios químicos.
- Una molécula de vapor de agua tiene la misma composición química, H2O, que una molécula de agua líquida o una molécula de hielo.
- La mezcla resultante de átomos neutros, iones con carga eléctrica positiva y electrones libres se llama plasma.
El
plasma no tiene forma o volumen definidos.
Los
plasmas pueden emitir luz debido al estado excitado de sus electrones
El
plasma es
muy abundante en el universo, constituyendo la mayoría de la materia visible en
las estrellas, como el Sol. Se puede producir y utilizar en experimentos de
laboratorio y en aplicaciones tecnológicas.
También hay plasma en algunos fenómenos naturales, como en las descargas
de rayos y en la ionosfera de los planetas.








No hay comentarios.:
Publicar un comentario